Wat isseldsame aarde?
Die mensdom het 'n geskiedenis van meer as 200 jaar sedert die ontdekking van seldsame aardmetale in 1794. Aangesien daar destyds min seldsame aardmetale gevind is, kon slegs 'n klein hoeveelheid wateronoplosbare oksiede deur chemiese metodes verkry word. Histories is sulke oksiede gewoonlik "aarde" genoem, vandaar die naam van seldsame aarde.
Trouens, seldsame aardminerale is nie skaars van aard nie. Seldsame aardmetale is nie aardmetale nie, maar 'n tipiese metaalelement. Die aktiewe tipe daarvan is slegs tweede na alkalimetale en alkalieaardmetale. Hulle het meer inhoud in die kors as gewone koper, sink, tin, kobalt en nikkel.
Tans word seldsame aardmetale wyd gebruik in verskeie velde soos elektronika, petrochemikalieë, metallurgie, ens. Byna elke 3-5 jaar kan wetenskaplikes nuwe gebruike vir seldsame aardmetale ontdek, en uit elke ses uitvindings kan 'n mens nie sonder seldsame aardmetale klaarkom nie.
China is ryk aan seldsame aardmetale en beklee die eerste plek in drie wêreldranglyste: reserwes, produksieskaal en uitvoervolume. Terselfdertyd is China ook die enigste land wat al 17 seldsame aardmetale kan voorsien, veral die medium- en swaar seldsame aardmetale met uiters prominente militêre toepassings.
Samestelling van seldsame aardelemente
Skaars aardelemente bestaan uit lantaaniedelemente in die periodieke tabel van chemiese elemente:lantaan(La),serium(Ce),praseodymium(Pr),neodymium(Nd), prometium (Pm),samarium(Sm),europium(Eu),gadolinium(God),terbium(Tb),disprosium(Dy),holmium(Ho),erbium(Er),tulium(Tm),ytterbium(Yb),lutetium(Lu), en twee elemente wat nou verwant is aan lantanied:skandium(Sc) enyttrium(J).

Dit word genoemSkaars Aarde, afgekort as Skaars Aarde.

Klassifikasie van seldsame aardelemente
Geklassifiseer volgens die fisiese en chemiese eienskappe van elemente:
Ligte seldsame aardelemente:skandium, yttrium, lantaan, cerium, praseodimium, neodymium, prometium, samarium, europium
Swaar seldsame aardelemente:gadolinium, terbium, dysprosium, holmium, erbium, thulium, ytterbium, lutetium
Geklassifiseer volgens mineraalkenmerke:
Seriumgroep:lantaan, serium, praseodymium, neodymium, promethium, samarium, europium
Yttriumgroep:gadolinium, terbium, dysprosium, holmium, erbium, thulium, ytterbium, lutetium, skandium, yttrium
Klassifikasie deur ekstraksieskeiding:
Ligte seldsame aarde (P204 swak suurheid ekstraksie)lantaan, serium, praseodimium, neodimium
Medium seldsame aarde (P204 lae suurheid ekstraksie):samarium, europium, gadolinium, terbium, disprosium
Swaar seldsame aardmetale (suurheidsonttrekking in P204):holmium, erbium, thulium, ytterbium, lutetium, yttrium
Eienskappe van seldsame aardelemente
Meer as 50 funksies van seldsame aardelemente hou verband met hul unieke 4f elektroniese struktuur, wat hulle wyd gebruik maak in beide tradisionele materiale en hoëtegnologiese nuwe materiaalvelde.
1. Fisiese en chemiese eienskappe
★ Het duidelike metaaleienskappe; Dit is silwergrys, behalwe vir praseodimium en neodimium, lyk dit liggeel
★ Ryk oksiedkleure
★ Vorm stabiele verbindings met nie-metale
★ Lewendige metaal
★ Maklik om in die lug te oksideer
2 Opto-elektroniese eienskappe
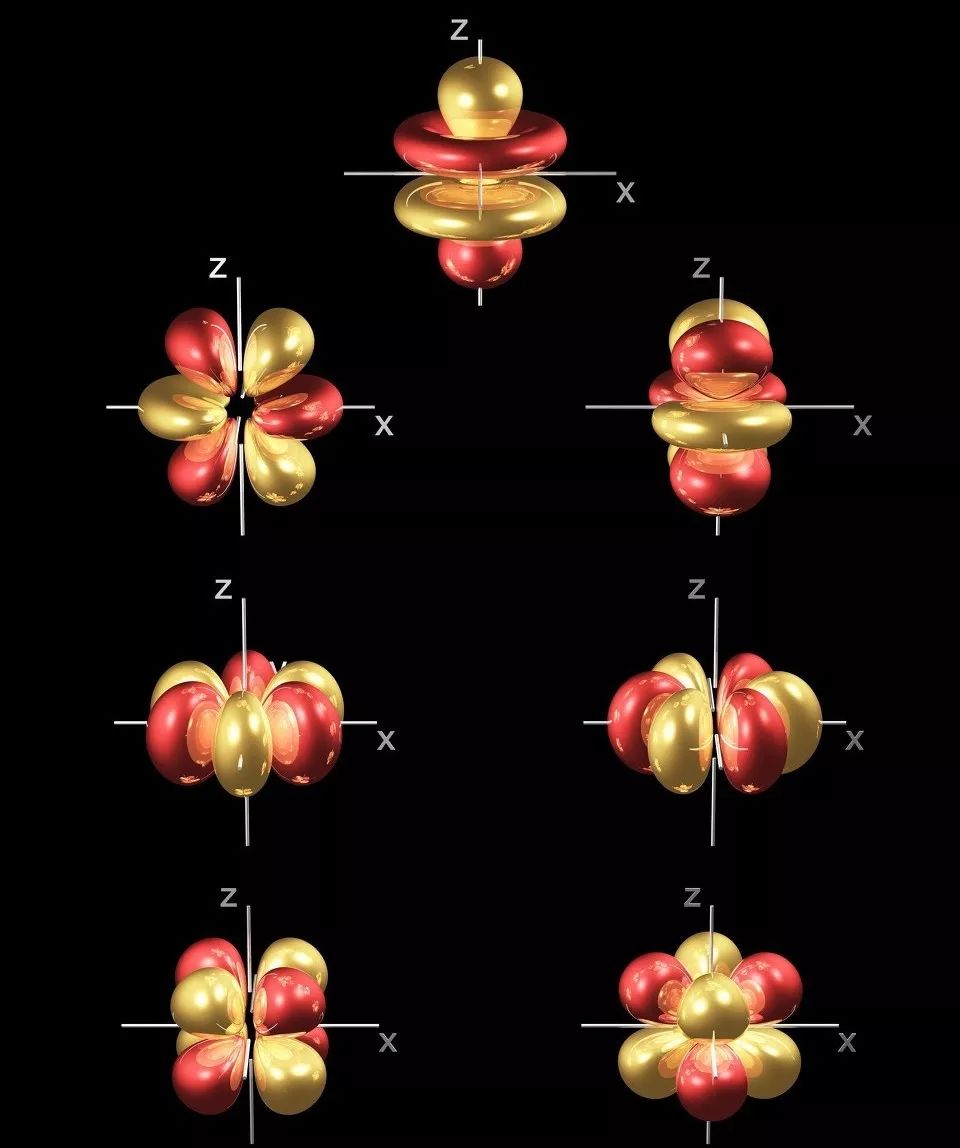
★ Ongevulde 4f-sublaag, waar 4f-elektrone deur buitenste elektrone afgeskerm word, wat lei tot verskeie spektrale terme en energievlakke
Wanneer 4f-elektrone oorgaan, kan hulle straling van verskillende golflengtes van ultraviolet, sigbaar tot infrarooi streke, absorbeer of uitstraal, wat hulle geskik maak as luminescerende materiale.
★ Goeie geleidingsvermoë, in staat om seldsame aardmetale deur elektrolise-metode voor te berei
Die Rol van 4f Elektrone van Seldsame Aarde Elemente in Nuwe Materiale
1.Materiale wat 4f elektroniese kenmerke gebruik
★ 4f elektronspin-rangskikking:gemanifesteer as sterk magnetisme – geskik vir gebruik as permanente magneetmateriale, MRI-beeldmateriaal, magnetiese sensors, supergeleiers, ens.
★ 4f orbitale elektronoorganggemanifesteer as luminescerende eienskappe – geskik vir gebruik as luminescerende materiale soos fosfore, infrarooi lasers, veselversterkers, ens.
Elektroniese oorgange in die 4f-energievlakgidsband: gemanifesteer as kleureienskappe – geskik vir die kleur en ontkleuring van warmkolkomponente, pigmente, keramiekolies, glas, ens.
2 is indirek verwant aan 4f elektron, deur gebruik te maak van ioniese radius, lading en chemiese eienskappe
★ Kernkenmerke:
Klein termiese neutronabsorpsie-dwarssnit – geskik vir gebruik as strukturele materiale van kernreaktore, ens.
Groot neutronabsorpsie-dwarssnit – geskik vir die afskerming van materiale van kernreaktore, ens.
★ Skaars aarde Ioniese radius, lading, fisiese en chemiese eienskappe:
Roosterdefekte, soortgelyke ioniese radius, chemiese eienskappe, verskillende ladings – geskik vir verhitting, katalisator, sensorelement, ens.
Strukturele spesifisiteit – geskik vir gebruik as katodemateriale vir waterstofbergingslegerings, mikrogolfabsorpsiemateriale, ens.
Elektro-optiese en diëlektriese eienskappe – geskik vir gebruik as ligmodulasiemateriale, deursigtige keramiek, ens.
Plasingstyd: 6 Julie 2023